- •
La cápsula endoscópica es una técnica mínimamente invasiva que permite el estudio del intestino delgado de forma ambulatoria.
- •
Las indicaciones más habituales son la hemorragia digestiva oculta seguido de la enfermedad de Crohn y los tumores intestinales.
- •
La imposibilidad de toma de biopsias y terapéutica endoscópica son sus principales limitaciones, pero combinada con la enteroscopia forma parte de una estrategia óptima para el estudio del intestino delgado.
- •
Existen métodos para aumentar su rentabilidad, como la realización de una preparación intestinal y la administración de simeticona.
- •
Su principal complicación es la retención intestinal, la cual se puede prevenir con la administración de la cápsula Patency en determinados casos.
La cápsula endoscópica (CE) es una técnica sencilla y bien tolerada que permite la visualización del intestino delgado de una forma mínimamente invasiva. Desde su aparición en el año 2000, ha mejorado el estudio de enfermedades gastrointestinales y ha modificado el enfoque diagnóstico de numerosos procesos del intestino delgado. Posteriormente, se ha desarrollado la técnica para el diagnóstico de las enfermedades del esófago y del colon.
Consiste en la deglución de una cápsula de 11 × 26 mm que contiene en su interior una pequeña cámara que obtiene fotografías (2-4 por segundo). Estas son transmitidas por radiotelemetría a unos sensores adheridos a la pared abdominal que permiten la captación de las imágenes, que se recogen en un grabador portátil durante 6-8 horas. Una vez finalizado el proceso de grabación se descargan a un ordenador, mientras que la cápsula es expulsada por las heces en las primeras 24-48 horas1.
Preparación del procedimientoLa presencia de gas intraluminal, residuos alimentarios y fluidos oscuros o biliosos, así como la imposibilidad de completar la visualización de todo el intestino delgado (batería insuficiente) constituyen limitaciones importantes en el estudio con cápsula. Para minimizar estos riesgos se recomienda:
1. Preparación intestinal: los estudios de que disponemos apoyan la realización de una preparación intestinal con solución evacuante, aunque todavía no está claro qué tipo de preparación es la mejor opción2–4. El metanálisis de Rokkas et al., publicado recientemente, concluye que los pacientes preparados con solución evacuante presentan imágenes de intestino delgado de más calidad, lo que supone una mejora en la capacidad diagnóstica de la cápsula. Hasta el momento no se ha demostrado que la preparación afecte al número de exploraciones completas, ni a los tiempos de tránsito gástrico e intestinal (grado de evidencia 2a y de recomendación B). Tampoco hay consenso acerca de cuál es la cantidad de solución evacuante óptima para el estudio con cápsula (1-2 l)5.
2. Administración de simeticona: la simeticona puede reducir la presencia de gas intraluminal, como constatan algunos estudios5,6, y los procinéticos parecen aumentar la probabilidad de conseguir un examen completo del intestino delgado al reducir el tiempo de tránsito gástrico7,8. La administración combinada de simeticona y metoclopramida mejora la visualización del intestino delgado y tiende a reducir el tiempo de tránsito gástrico e intestinal, aunque no de forma significativa9.
Actualmente, en la práctica habitual, la preparación consiste en la ingesta de 2 l de PEG (polietilenglicol), con lo que mejora la visualización de tramos distales de íleon. La administración de simeticona y metoclopramida la reservamos para casos seleccionados (pacientes encamados, con movilidad reducida, evidencia o sospecha de gastroparesia o aquellos con estudios previos no concluyentes).
Una vez administrada la cápsula y colocados los sensores que captan las imágenes que emitirá, se recomienda al paciente que durante el día realice una actividad física moderada para facilitar el desplazamiento de la cápsula por el intestino delgado. Tras 8-9 horas, volverá al hospital, donde se le retirará la grabadora y el cinturón, y se procederá a descargar el estudio para su posterior revisión.
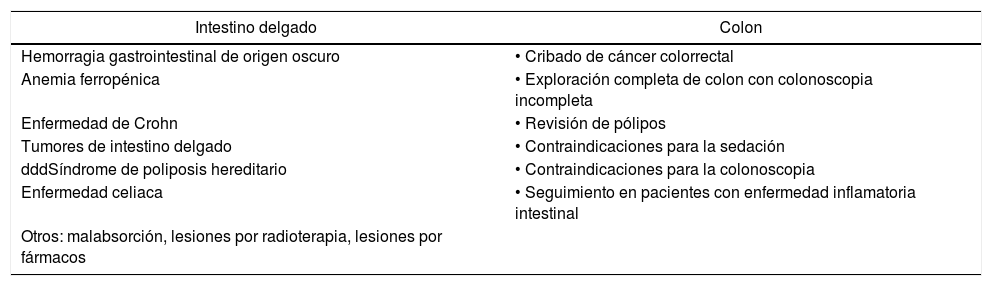
Indicaciones y contraindicacionesEn la tabla 1 se exponen las indicaciones actuales de la CE.
Indicaciones actuales de la cápsula endoscópica
| Intestino delgado | Colon |
|---|---|
| Hemorragia gastrointestinal de origen oscuro | • Cribado de cáncer colorrectal |
| Anemia ferropénica | • Exploración completa de colon con colonoscopia incompleta |
| Enfermedad de Crohn | • Revisión de pólipos |
| Tumores de intestino delgado | • Contraindicaciones para la sedación |
| dddSíndrome de poliposis hereditario | • Contraindicaciones para la colonoscopia |
| Enfermedad celiaca | • Seguimiento en pacientes con enfermedad inflamatoria intestinal |
| Otros: malabsorción, lesiones por radioterapia, lesiones por fármacos |
La retención de la CE es la complicación más frecuente. Se define como la presencia de la CE en intestino delgado durante más de 2 semanas y ocurre aproximadamente en una de cada 100-150 exploraciones (0,75-1%) en general y hasta en un 13% en pacientes con enfermedad de Crohn (EC)10. En estos casos, la conducta a seguir pasa por una actitud expectante hasta su expulsión espontánea en pacientes asintomáticos, o la extracción diferida o urgente mediante una endoscopia digestiva baja o quirúrgica.
Son contraindicaciones absolutas11:
- •
Estenosis conocida del tracto gastrointestinal.
- •
Retención de la cápsula Agile Patency o su expulsión deformada. La cápsula Agile Patency es una cápsula reabsorbible que no realiza fotografías y permite constatar la permeabilidad intestinal. Tiene las mismas dimensiones que la CE convencional y 2 ventanas en sus extremos por donde se inicia su desintegración (a las 30 h de la ingesta) en caso de quedar retenida en una estenosis. La cápsula reabsorbible se administra unos días antes de la CE convencional en casos de sospecha o riesgo de estenosis (EC, consumo crónico de antiinflamatorios no esteroideos, dolor abdominal, estenosis radiológica conocida)12.
- •
Embarazo.
Son contraindicaciones relativas:
- •
Dispositivos cardíacos implantables (marcapasos, desfibriladores)13. La CE es segura en pacientes con marcapasos, pero los pacientes portadores de desfibriladores deberían ser controlados con monitorización intrahospitalaria.
- •
Problemas de deglución, como una disfagia orofaríngea o un divertículo de Zenker. En estos casos se puede introducir la CE con un dispositivo acoplado al endoscopio que sujeta la cápsula y la libera en el punto deseado14.
A continuación, vamos a desarrollar las principales indicaciones.
Hemorragia digestiva de origen oscuroLa hemorragia digestiva de origen oscuro (HDOO) se define como un sangrado persistente o recurrente sin que se identifique su origen tras la realización de una endoscopia digestiva alta y baja. Representa el 5% del total de los sangrados digestivos y generalmente es causada por lesiones de intestino delgado. Presenta dos formas clínicas: a) HDOO manifiesta, cuando hay evidencia macroscópica del sangrado y b) HDOO oculta, en caso de anemia ferropénica, y su detección es a través de un test de sangre oculta en heces15.
La técnica recomendada para el estudio de la HDOO en las diferentes guías clínicas es la CE16,17. Presenta una sensibilidad del 88,9%, una especificidad del 95%, un valor predictivo positivo (VPP) del 97% y un valor predictivo negativo (VPN) del 82,4%17. La tasa de positividad de la CE aumenta si la indicación es la HDOO manifiesta1; por eso se recomienda su realización lo antes posible después del episodio de sangrado, a poder ser dentro de las primeras 48 horas19–22.
Comparado con otras técnicas, su rendimiento es superior a la enteroscopia de pulsión y a la tomografía computarizada23. Sin embargo, cuatro metanálisis han evaluado sus resultados frente a la enteroscopia de doble balón en la HDOO y el rendimiento de ambas técnicas fue similar para la HDOO24. La CE ofrece una mayor tasa de enteroscopias completas, menor número de complicaciones y mayor tolerabilidad. Mejora el rendimiento diagnóstico de la enteroscopia dado que ayuda a seleccionar la vía de acceso óptima25; por tanto, se recomienda la CE como estudio inicial de la HDOO seguido de una enteroscopia para el abordaje endoscópico terapéutico posterior, con lo que se consigue un 87% del control de los sangrados.
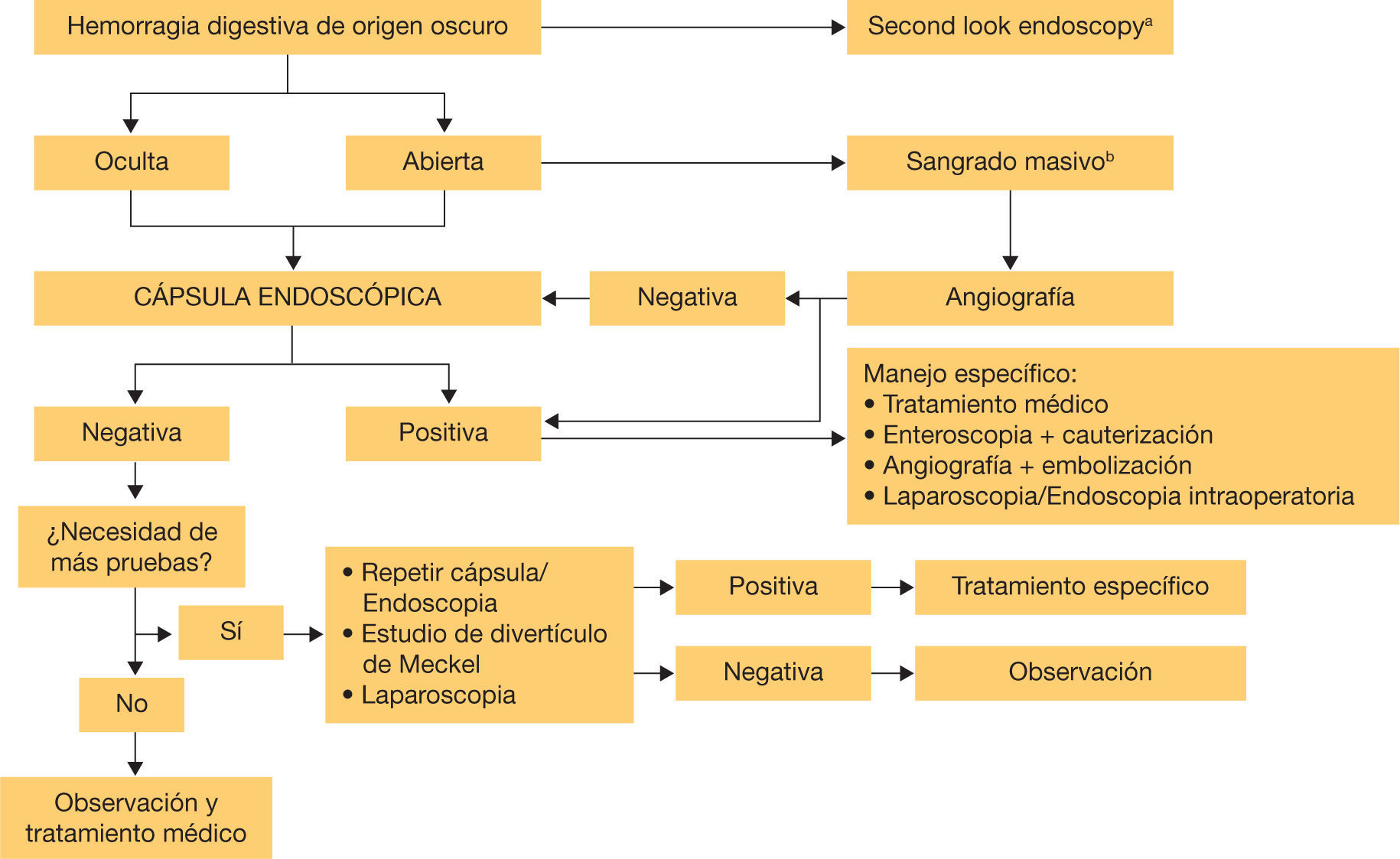
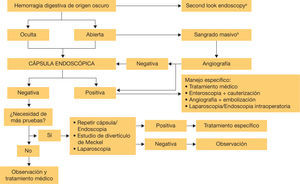
En pacientes con anemia ferropénica su rendimiento es menor (aproximadamente del 53%), por lo que se recomienda su uso una vez completado el estudio con gastroscopia con toma de biopsias gástricas y duodenales y una ileocolonoscopia sin hallazgos que justifiquen la anemia, además de haber descartado un origen ginecológico en mujeres premenopáusicas15. Por otro lado, es aconsejable administrar suplementos de hierro antes de investigar la presencia de lesiones en intestino delgado mediante CE, ya que aumenta el rendimiento diagnóstico del procedimiento cuando se realiza solo en aquellos pacientes en los que la anemia no responde al tratamiento, o recurre tras la retirada del mismo26,27 (sin embargo, esta estrategia podría conllevar un retraso diagnóstico, por lo que se debe individualizar según cada caso, priorizándola en pacientes mayores y/o con comorbilidades asociadas). En la figura 1 exponemos el algoritmo diagnóstico y terapéutico de la HDOO.
Algoritmo diagnóstico y terapéutico de la hemorragia digestiva de origen oscuro.
aConsiderar repetir la gastroscopia antes de completar el estudio con cápsula endoscópica en pacientes con hemorragia digestiva de origen oculto en pacientes con hematemesis o melena recurrente o en casos de una exploración previa incompleta.
bEn caso de sangrado abierto masivo, sobre todo en pacientes con inestabilidad hemodinámica, estaría indicado angiografía urgente para intentar identificar el punto de sangrado activo y plantear terapéutica con embolización o abordaje endoscópico dirigido antes de realizar estudio con cápsula endoscópica.
Las principales indicaciones en EII son:
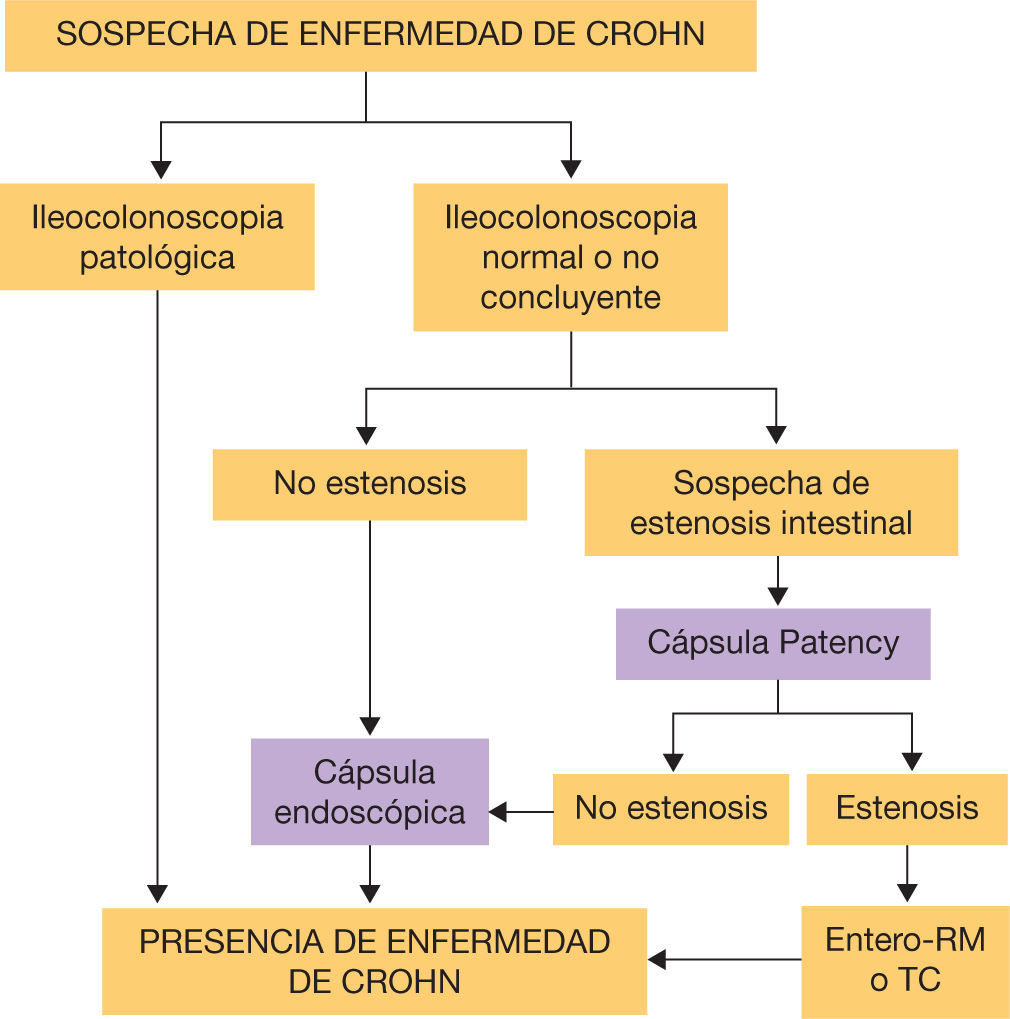
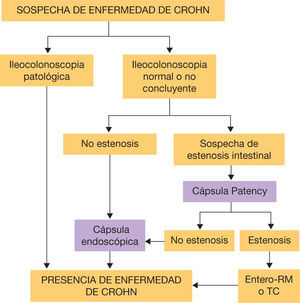
Sospecha de enfermedad de Crohn: hasta un 60% de los pacientes con EC presentan afectación en el intestino delgado en el momento del diagnóstico y aproximadamente el 90% de los enfermos con EC de intestino delgado tienen lesiones en el íleon terminal, por lo que la ileocolonoscopia se considera la primera exploración a realizar cuando existe sospecha de EC28. En pacientes con resultados negativos pero alta sospecha de EC, se recomienda evaluar el resto de intestino delgado mediante la CE en ausencia de síntomas obstructivos o estenosis conocidas29. En estos casos se debe administrar antes la cápsula Patency para garantizar permeabilidad intestinal. La presencia de 3-5 úlceras o 10 aftas son compatibles con EC; sin embargo, en ocasiones los hallazgos pueden ser inespecíficos y se recomienda combinar los resultados con los parámetros analíticos y manifestaciones extrantestinales para aumentar la sensibilidad30. En caso de toma de AINE se deben retirar un mes antes del procedimiento, debido a que pueden causar lesiones indistinguibles de las producidas por la EC31. En la figura 2 se muestra un algoritmo diagnóstico que evalúa la CE en caso de sospecha de EC con estudio endoscópico no concluyente32..
Estudio de extensión de la EC y valoración de respuesta al tratamiento: la afectación del intestino delgado y/o las lesiones localizadas a nivel proximal son factores de mal pronóstico en la EC y estos hallazgos pueden influir en las decisiones terapéuticas33,34. En el caso de la EC ya diagnosticada, la CE es una exploración que contribuye a valorar la actividad, sobre todo en pacientes donde los síntomas son inespecíficos y con resultados negativos en el resto de exploraciones complementarias. Actualmente, el objetivo de tratamiento es alcanzar la curación mucosa y no solo la remisión sintomática35, y estos hechos no siempre están relacionados como muestra el estudio de Rutgeerts et al., donde solo un 67% de los pacientes en tratamiento con infliximab presentaron remisión sintomática y curación mucosa36, por lo que la CE es una buena herramienta para confirmar la remisión endoscópica mediante el uso de los índices endoscópicos como la escala de Lewis o el CECDAI.
Valoración de la recurrencia posquirúrgica en la EC: la técnica estándar es la ileocolonoscopia a los 6-12 meses de la resección mediante índice endoscópico de Rutgeerts. Sin embargo, la CE debe ser considerada tras una colonoscopia negativa para valorar la presencia de lesiones proximales tras la cirugía, una sensibilidad del 62-93% y una especificidad del 67-76% en la detección de lesiones37.
Al comparar la CE con el resto de opciones diagnósticas presenta un rendimiento superior respecto el tránsito intestinal (TI) (71% CE vs. 36% TI), como con la entero-TC (70% CE vs. 31% entero-TC)38,39. La ventaja de la entero-TC es que permite la identificación de complicaciones extraluminales, como la presencia de fístulas o abscesos. Hay múltiples estudios que comparan la CE con la entero-RM, de los que se concluye que la CE es superior en la detección de lesiones mucosas, de forma precoz y en segmentos proximales del intestino delgado. A su vez, la RM permite valorar la totalidad de la pared intestinal, la afectación extraluminal y estenosis40. Por tanto, parece que ambas técnicas son complementarias, y utilizadas conjuntamente podrían caracterizar mejor la patología de intestino delgado.
Tumores de intestino delgado y síndrome de poliposis hereditariaEl intestino delgado es una localización infrecuente de neoplasias. Las entidades que se asocian con mayor frecuencia son linfoma folicular tipo no hodgkiniano, tumor neuroendocrino y metástasis de un melanoma primario; y en menor frecuencia, linfoma de células T en relación con enfermedad celiaca y adenocarcinoma primario41,42. La localización más frecuente es el yeyuno (40-60%), seguido de íleon (25-40%) y duodeno (15-20%).
La HDOO es el signo más común en pacientes con tumores del intestino delgado detectados mediante una cápsula, y se identifican en un 6-12%43. Por ello, la European Society of Gastrointestinal Endoscopy (ESGE) recomienda su uso en caso de HDOO y anemia no explicada por otros motivos como se ha comentado anteriormente. Una vez diagnosticada la lesión por cápsula es aconsejable realizar una TC de abdomen para planificar la cirugía si se considera indicada y concretar la localización. Sin embargo, cuando se requiere confirmar un tumor de intestino delgado visto por radiología, se recomienda realizar una enteroscopia en lugar de CE para así obtener un diagnóstico histológico. Otra indicación aceptada para la CE es el seguimiento de tumores una vez resecados44,45. Las principales limitaciones son: imposibilidad de toma de biopsias, frecuencia no despreciable de falsos negativos y positivos debido a la dificultad para diferenciar pliegues prominentes y tumores submucosos, así como el riesgo de retención de la propia CE (10-25%).
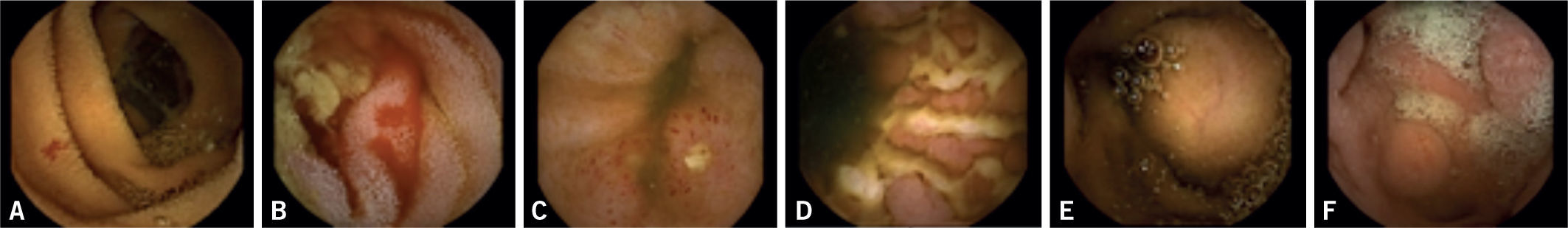
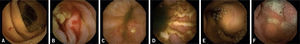
Imágenes de cápsula endoscópica. A) Angiodisplasia yeyunal sangrante en paciente con anemia ferropénica. B) Angiodisplasia yeyunal con sangrado activo. C) Úlcera y eritema yeyunal en paciente con sospecha de enfermedad de Crohn. D) Múltiples úlceras en paciente con enfermedad de Crohn ya conocida. E) Tumor submucoso. F) Pólipo yeyunal.
Respecto a los síndromes polipósicos, principalmente destaca su utilidad en la poliposis adenomatosa familiar (PAF) y el síndrome de Peutz-Jegher. En caso de la PAF, dado que presentan mayor riesgo de pólipos en tramos proximales, sobre todo en papila duodenal, la técnica de elección es la duodenoscopia46, pero la CE podría ser útil para valorar el resto de intestino delgado47. En el síndrome de Peutz-Jegher, tanto la CE como la entero-RM parecen ser útiles en el estudio de pólipos en intestino medio y su mayor beneficio se observa en pólipos de 10-15 mm situados a nivel de intestino delgado distal para posteriormente programar su eventual resección con enteroscopia48,49.
Cápsula endoscópica de colonLa cápsula endoscópica de colon (CCE) dispone de un doble cabezal con un amplio ángulo de visión de 156-172 que permite valorar la mucosa entre las haustras de colon. La última generación desarrollada (Pillcam Colon 2) presenta para pólipos de 6 mm o más una sensibilidad del 84-91% y una especificidad del 89%40; además, la duración de la batería es mayor respecto a la primera versión de CCE. La ESGE recomienda su uso en el cribado del cáncer colorrectal como alternativa a la colonoscopia, y en 2014 la US Food and Drug Administration aceptó su uso para pacientes con colonoscopias incompletas. Sin embargo, entre sus limitaciones destaca la imposibilidad de mejorar la preparación intestinal (no aspiración de líquido claro remanente en el colon), tampoco toma de biopsias ni terapéutica endoscópica, así como su coste más elevado respecto a la colonoscopia. La complicación más temida es la retención en el 1,4% de los casos41..
ConclusiónLa cápsula ha presentado un desarrollo rápido en los últimos años, hasta el punto de ser considerada un instrumento fundamental en el estudio del intestino delgado. En particular, la HDOO, la EC y los tumores son las indicaciones más relevantes. A pesar de sus limitaciones, como la imposibilidad de toma de biopsias y práctica de terapéutica, las múltiples estrategias combinadas con técnicas de imagen y la enteroscopia de balón la ha convertido en una técnica más dentro de la práctica clínica habitual.
Tal vez en un futuro no muy lejano los avances tecnológicos lograrán aumentar la eficacia y la capacidad diagnóstica de los sistemas de endoscopia capsular, e incluso realizar maniobras terapéuticas: las baterías recargables desde el exterior evitarán los problemas de duración de estas, se logrará teledirigir el dispositivo, y la miniaturización de los componentes de la cápsula liberará espacios para diferentes necesidades clínicas (realización de biopsias o la liberación de fármacos).
- Inicio
- Todos los contenidos
- Publique su artículo
- Acerca de la revista
- Métricas
- Acreditación oficial