La vitamina D es un nutriente esencial.
La principal fuente es la síntesis cutánea. La dieta supone entre un 10% y un 20% del aporte diario.
La principal causa de déficit de vitamina D es la falta de sol o los trastornos malabsortivos.
Cuando está clínicamente indicado, la determinación de la concentración sérica de 25-hidroxivitamina D [25?(OH)?D] es la medida de elección para conocer el estatus de vitamina D.
La principal consecuencia del déficit severo de vitamina D es el raquitismo en niños y la osteomalacia en adultos.
Los beneficios extraóseos todavía no están completamente demostrados.
No se recomienda el cribado poblacional.
Puede estar indicada la determinación de vitamina D en grupos de riesgo concretos.
Las concentraciones séricas de 25?(OH)?D> 20 ng/ml (50 nmol/l) pueden ser suficientes para la población general.
Se recomiendan suplementos de 400-800 UI/día sin necesidad de determinación previa de 25?(OH)?D, ni monitorización en grupos de especial riesgo de déficit.
En los últimos años se ha producido un creciente interés por la vitamina D1, con notable incremento en el número de determinaciones en todo el mundo2. Sin embargo, en el momento actual hay controversia acerca de si realmente son necesarias estas determinaciones y acerca de cuál es el punto de corte para definir deficiencia de vitamina D. Es posible que no pueda establecerse un punto de corte único y que haya que valorar diferentes escenarios, como los representados por los pacientes con osteoporosis, con insuficiencia renal, con diabetes u otras circunstancias.
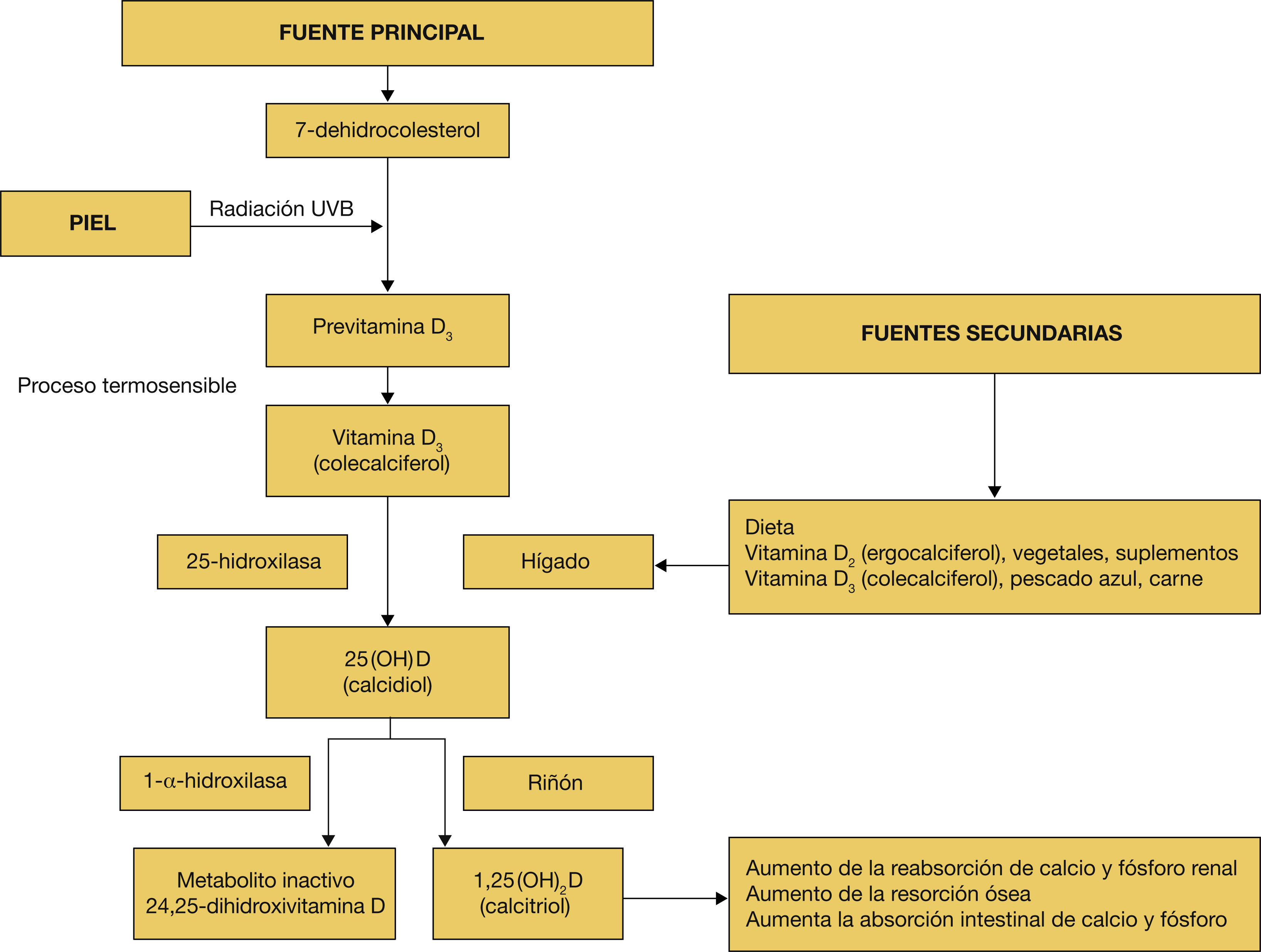
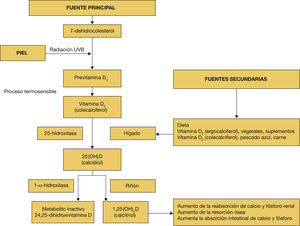
Fisiología de la vitamina DLa vitamina D y sus metabolitos son considerados por algunos autores como un complejo hormonal. La síntesis cutánea es la principal fuente natural de vitamina D. El primer paso en la producción endógena de vitamina D es la conversión, por efecto de la irradiación solar ultravioleta B de longitud de onda entre 290 y 315nm, de 7 dehidrocolesterol (7-DHC) a precolecalciferol3. La dosis respuesta no es lineal, de manera que exposiciones más prolongadas no se acompañan necesariamente de aumento proporcional en la síntesis de previtamina D. Suele limitarse por factores como la piel morena, el uso de cremas protectoras solares (factor de protección [FP]> 8), la edad, la latitud, la hora del día y la época del año. El precolecalciferol es una sustancia muy inestable, y por efecto de la temperatura corporal se convierte rápidamente en colecalciferol, el cual, unido a la proteína transportadora de la vitamina D, llega al hígado4
Además de la síntesis cutánea, la vitamina D puede obtenerse en menor medida de los alimentos tanto de origen animal (colecalciferol) como vegetal (ergocalciferol). Fun-damentalmente, pescados grasos, el principal el salmón salvaje, también el aceite de hígado de bacalao, la yema de huevo, algunos lácteos, hígado y otras vísceras y algunos alimentos enriquecidos (tabla 1)5.
fuentes naturales de vitamina d
| Fuente | Contenido en vitamina D |
|---|---|
| Salmón• Fresco (salvaje) (100 g)• Fresco (piscifactoría) (100 g)• Enlatado (100 g) | 600-1.000 UI100-250 UI300-600 UI |
| Sardinas (en lata) | 300 UI |
| Atún (en lata) | 230 UI |
| Aceite de hígado de bacalao (5 ml) | 400-1.000 UI |
| Yema de huevo | ?20 UI |
| Champiñones frescos (100 g) | 100 UI |
| Champiñones secos al sol | 1.600 UI |
| Leche enriquecida (240 ml) | 100 UI |
| Cereales enriquecidos (ración) | 100 UI |
| Adaptado de: Holick M5. |
La previtamina D procedente de la dieta o de la piel no presenta actividad por sí misma y precisa de dos hidroxilaciones: una primera, hepática, que hidroxila la vitamina D a 25-hidroxivitamina D [25?(OH)?D] y una segunda renal que transforma la 25?(OH)?D en 1,25-hidroxivitamina D [1,25?(OH)?D] (o calcitriol), la forma activa, y también el metabolito inactivo de la 24,25-dihidroxivitamina D (fig. 1).
Efectos clínicosLa vitamina D tiene un papel crucial en el metabolismo óseo6. Mantiene el balance fosfocálcico, regula el remodelado óseo y también se considera que es necesaria una concentración adecuada para optimizar la eficacia de los diferentes tratamientos para la osteoporosis. Es verdad que el receptor nuclear de la vitamina D se ha identificado en casi todas las células del organismo, incluyendo cerebro, corazón, piel, célula ? pancreática, próstata, gónadas, mama, colon y células del sistema inmunitario, lo que ha hecho sospechar que podría desempeñar otras funciones.
También se ha descrito actividad de 1-?-hidroxilasa en numerosas células extrarrenales.
Efectos óseosLa acción fundamental de la vitamina D es la regulación del metabolismo del calcio y del fósforo, con el fin de mantener las concentraciones de estos iones estables en sangre y la adecuada mineralización del esqueleto7. Cuando existe déficit de vitamina D solo se absorbe un 10-15% del calcio y un 50-60% del fósforo de la dieta8. Este déficit puede originar una caída transitoria del calcio ionizado que estimula la síntesis y secreción de hormona paratiroidea (PTH). El hiperparatiroidismo secundario estimula la producción renal de calcitriol y aumenta la producción y maduración de los osteoclastos, que movilizan el calcio de los depósitos óseos para conseguir mantener la calcemia en rango normal. A nivel renal, el hiperparatiroidismo secundario induce la pérdida de fósforo por la orina, lo que supone un producto calcio-fósforo inadecuado que contribuye al defecto de la mineralización ósea9. No todos los sujetos desarrollan hiperparatiroidismo secundario cuando disminuye la vitamina D. La causa de esta respuesta variable no se conoce con certeza, pero se relaciona, además de con el estatus de vitamina D, con otros factores que influyen en la PTH, como la masa grasa, la estación del año, el ejercicio físico, la función renal o la ingesta de calcio dietético, entre otros10.
Las consecuencias clásicas del déficit sostenido y severo de vitamina D son el raquitismo en niños y la osteomalacia en adultos11. También se le atribuye un papel en la osteoporosis12. Los resultados en prevención de fracturas, efecto sobre la musculatura y la prevención de caídas son diversos según las características de los pacientes incluidos en los estudios, los valores basales de 25?(OH)?D y otras características13–15. Se benefician más los que tienen valores bajos de 25?(OH)?D (<30 nmol/l;<12 ng/ml) y alto riesgo de caídas y/o frac-turas16,17.
Las concentraciones bajas de vitamina D se han asociado a una amplia variedad de procesos y enfermedades no esqueléticas18,19 entre las que destacan la patología cardiovascular20,21, la hipertensión, la diabetes, alteraciones inmunitarias, el cáncer22 y la depresión23. Toda esta información procede de estudios observacionales y la plausibilidad biológica; sin embargo, los estudios prospectivos controlados con placebo que deberían corroborar la eficacia de incrementar esas concentraciones no muestran resultados concluyentes24.
Un reciente metanálisis25 que revisa la evidencia de las últimas publicaciones entre 2012 y 2017 encuentra beneficio en infecciones del tracto respiratorio, agudizaciones de asma y mortalidad por cáncer. Y aunque las concentraciones de 25?(OH)?D finales son más altas que en estudios anteriores, no encuentran beneficio de la suplementación para condiciones como la patología cardiovascular, el metabolismo de la glucosa, la función muscular o el adenoma colorrectal.
Puede ser que la ausencia de beneficio extraesquelético obtenida en diversos estudios que evalúan el efecto de suplementos de vitamina D sea debida a que son estudios demasiado pequeños, con dosis bajas de vitamina D, de corta duración o también que muchos de los participantes no son deficientes en 25?(OH)?D26.
La reciente publicación del estudio VITAL27 (The Vitamin D and Omega-3 Trial) concluye que la suplementación con vitamina D en adultos sanos no redujo la incidencia de cáncer invasivo o eventos cardiovasculares.
Otros estudios que están en marcha, también con un número importante de participantes, quizá arrojen más luz sobre el tema.
Déficit de vitamina DLa principal fuente de vitamina D es la exposición solar típicamente entre las 10 y las 15 horas en primavera, verano y otoño. Por encima de la latitud 33°, la síntesis de vitamina D en invierno es muy pequeña o nula28. Pocos alimentos contienen de manera natural vitamina D en cantidad suficiente para cubrir las necesidades diarias. Por tanto, la primera causa del déficit de vitamina D es una exposición solar insuficiente. Las cremas protectoras solares reducen en diferente medida esta síntesis cutánea (las cremas con FP a partir de 8 reducen la síntesis de D3 en un 92,5% y el FP 15, en un 99%). Los individuos de piel oscura (por su mayor cantidad de melanina) tienen una “protección natural” a la radiación UV. Requieren exposiciones más prolongadas, de 3 a 5 veces superiores a los de tez clara. El contenido de 7-dehidrocolesterol de la epidermis disminuye con la edad. Si bien se estima que la exposición durante 5-15min/día en cara y brazos en primavera, verano y otoño es capaz de mantener unos depósitos adecuados en la población más joven, la capacidad de síntesis cutánea en una persona de 70 años es un 75% inferior. También contribuye al déficit de los ancianos la menor ingesta de alimentos ricos en vitamina D29.
Los pacientes con obesidad presentan concentraciones más bajas de 25?(OH)?D. Se ha descrito una relación inversa entre valor plasmático de 25?(OH)?D y un índice de masa corporal (IMC) superior a 30 kg/m2.
Otras causas de déficit de vitamina D son los síndromes de malabsorción intestinal y los tratamientos de cirugía bariátrica30, que limitan la absorción de vitamina D, y los pacientes con síndrome nefrótico, que pierden 25?(OH)?D unido a proteína transportadora por la orina.
Por último, también tienen déficit de vitamina D los pacientes en tratamiento con anticonvulsivos y tratamientos para la infección por el virus de la inmunodeficiencia humana (estos fármacos aumentan el catabolismo de la 25?(OH)?D y de la 1,25?(OH)?D). También los pacientes con enfermedades crónicas granulomatosas y los que presentan hiperparatiroidismo primario o secundario (aumento el metabolismo de 25 a 1,25 (OH)2 D) (tabla 2)31.
Causas de déficit de vitamina D
| Reducción de la síntesis de vitamina D cutáneaUso de cremas solaresTez oscuraEdadLatitud, estación, hora del díaNo exposición al sol | FP8, reducción del 92,5% y FP15, 98-99%Absorción por la melanina, reduce la síntesis hasta un 99%Reducción de 7-DHC, reduce progresivamente la síntesis hasta un 75% en mayores de 70 añosMayor latitud (>35°) rayos más oblicuos; en invierno disminuye en algunas zonas hasta un 80%. Horario óptimo entre las 10 y 15 horas |
| Disminución en la biodisponibilidadMalabsorción de grasas como: fibrosis quística, celiaquía, enfermedad de Crohn, by-pass gástrico, algunas medicaciones como colesteramina, orlistat | |
| Obesidad (secuestro de vitamina D en tejido graso) | Disminución de la biodisponibilidad |
| Aumento del catabolismoAnticonvulsivos, glucocorticoides, terapia HAART | Aumenta la degradación |
| Otras:Lactancia materna exclusiva en mayores de 6 mesesInsuficiencia hepáticaInsuficiencia renalSíndrome nefróticoEnfermedades hereditarias relacionadas con el raquitismoEnfermedades granulomatosas | |
| 7-DHC: 7-dehidrocolesterol; FP: factor de protección. |
El número de determinaciones de vitamina D ha aumentado de manera exponencial en los últimos años en muchos países. En los Estados Unidos aumentó más de 80 veces entre 2000 y 2010 (p> 0,007)32. En Francia33, entre 2008 y 2013 el número anual de determinaciones se incrementó aproximadamente 8 veces (de 9.620 a 80.297). También aumentó de manera similar el número de pacientes a los que se les determinó al menos una vez la concentración de 25?(OH)?D (de 5.420 a 48.841). El incremento de las solicitudes fundamentalmente se generó en atención primaria, que pasó de 5.200 a 53.700 solicitudes, y menos en otras especialidades, tanto ambulatorias como en el ámbito hospitalario.
En Liverpool (Reino Unido)34 analizaron el incremento en el número de solicitudes de vitamina D generadas en atención primaria entre 2007 y 2012. En los 6 años del estudio, el número de peticiones aumentó 11 veces (de 503 a 5.552).
En nuestro país, Salinas35 y colaboradores estudiaron la variabilidad territorial y temporal (2012-2014) en el número de solicitudes de determinación de vitamina D. En la primera fase participaron 66 laboratorios distribuidos por toda España, y en la segunda 110, y correspondían a 17.679.195 y 27.790.262 sujetos, respectivamente (58% de la población española). En el periodo de estudio, el número de solicitudes por 1.000 habitantes aumentó de 1,1 en 2012 a 3,4 en 2014 (p <0,001). Había una variabilidad significativa entre las distintas comunidades autónomas que iba de 0,94 a 21,4 (p=0,002). El número de solicitudes era inferior en zonas con mayor número de horas de insolación y en aquellas con criterios restrictivos para su solicitud.
Algunos estudios36 han demostrado que herramientas de ayuda en la toma de decisiones a la hora de solicitar la determinación de vitamina D, incorporadas a la historia clínica informatizada, pueden reducir el número de pruebas inadecuadas.
El mejor método para determinar el estatus de vitamina D consiste en medir la concentración plasmática de 25?(OH)?D. Es la forma circulante predominante, con una vida media de 2-3 semanas9.
No se recomienda la determinación de 1,25?(OH)?D, salvo en casos muy seleccionados donde se sospecha deficiencia de ?-hidroxilasa.
Existen diferentes métodos para la determinación de 25?(OH)?D; los más ampliamente empleados son los de inmunoensayo competitivo y la cromatografía líquida acoplada a espectrometría en tándem de masas (LC_MS/MS)36–39. La mayoría de los estudios realizados en los últimos 20-30 años han empleado la técnica de inmunoensayo41 y aún hoy es la técnica empleada en muchos laboratorios. Su principal limitación es la precisión y la variabilidad, que puede alcanzar el 15-20%. Estas técnicas frecuentemente subestiman o sobrestiman las concentraciones de 25?(OH)?D en el extremo más alto y bajo de su rango de medición, justamente donde la precisión sería más importante. La cromatografía líquida acoplada a espectrometría en tándem de masas es considerada actualmente el patrón de referencia, por su mayor precisión, especificidad, sensibilidad y reproducibilidad.
El programa de estandarización de la vitamina D42 especifica que un 10% es una variación aceptable en la precisión. En la práctica, este nivel de precisión indica que si el valor de la determinación es de 30 ng/ml, con un 95% de certeza, podemos asegurar que el valor estará entre 24 y 36 ng/ml (60-90 nmol/l).
La concentración plasmática de 25?(OH)?D presenta gran variabilidad intraindividual e interindividual43. Influyen en esta variabilidad la estación del año, la edad, el IMC, la raza, la pigmentación cutánea, la exposición solar, la alimentación, los estilos de vida y factores genéticos. Todos estos valores, y concretamente la variación estacional, deben ser siempre considerados cuando se solicita la medida de 25?(OH)?D sérica y se interpretan los resultados.
Existe controversia acerca de cuáles son los valores de concentraciones de 25?(OH)?D óptimas.
Diversas organizaciones y sociedades científicas establecen distintas concentraciones para hablar de deficiencia, insuficiencia o valores óptimos de vitamina D.
El Institute of Medicine (IOM)44 formuló sus recomendaciones en 2011, donde definen la deficiencia cuando la concentración de 25?(OH)?D es inferior a 12 ng/ml (30 nmol/l); la insuficiencia, cuando oscila entre 12 y 20 ng/ml (30-50 nmol/l), y adecuada por encima de 20 ng/ml (>50 nmol/l). Otras organizaciones también apoyan esta recomendación29.
En el mismo año, la American Society of Endocrinology6 también emitió sus recomendaciones, considerando adecuadas concentraciones por encima de 30 ng/ml (>77,5 nmol/l), insuficientes, entre 20 y 30 ng/ml (52,5-72,5 nmol/l), y deficientes cuando es inferior a 20 ng/ml (<50 nmol/l).
Ambos coinciden45 en que valores por debajo de 10-12 ng/ml (25-30 nmol/l) reflejan deficiencia severa y se asocian con un mayor riesgo de raquitismo, osteomalacia o dolor difuso (tabla 3).
¿A quién se recomienda determinar las concentraciones séricas de 25?(OH)?D?
| Población con patología crónica o tratamientos que afecten a la absorción o al metabolismo de la vitamina D |
|---|
| Enfermedad renal crónica severa (grado IV o V) |
| Enfermedad hepática crónica |
| Osteoporosis/fracturas por fragilidad |
| Patología metabólica ósea: sospecha de raquitismo (niños)/osteomalacia (adultos), enfermedad de Paget |
| Síndromes de malabsorción (cirugía bariátrica, celiaquía, enfermedad de Crohn, fibrosis quística) |
| Pacientes tratados con fármacos que afectan a la absorción y/o el metabolismo de la vitamina D, como anticonvulsivos, glucocorticoides, antirretrovirales, antiproteasa, antifúngicos o colesteramina |
| Hipoparatiroidismo o hiperparatiroidismo |
| Hipocalcemia o hipercalcemia/hiperfosfatemia o hipofosfatemia |
| Valores inexplicablemente elevados de fosfatasa alcalina sérica |
| Sospecha de toxicidad: pacientes que toman dosis elevadas de vitamina D durante largos periodos, con alteraciones analíticas (hipercalcemia, inhibición de la PTH) o sintomatología característica asociada |
| PTH: hormona paratiroidea. |
Probablemente, para la población general (adultos mayores de 18 años) son suficientes concentraciones superiores a 20 ng/ml que cubren, según el IOM, al 97,5% de la población (americana), y en pacientes con patología del metabolismo óseo, trastornos digestivos, renales u otros objetivos serán óptimas las concentraciones superiores a 30 ng/ml.
A quién cribarHoy por hoy no hay evidencia que demuestre los beneficios del cribado del déficit de vitamina D en la población general46–49. Haría falta demostrar factibilidad, coste-efectividad y beneficios en términos de salud50. En ausencia de esta evidencia no se recomienda el cribado en sujetos que no presenten riesgo. Se recomienda la determinación solo en sujetos con síntomas (debilidad, dolor muscular, dolor óseo generalizado) o signos de deficiencia o pacientes con riesgo de padecerla y en los cuales se espera una rápida respuesta tras la optimización de la concentración de 25?(OH)?D (tabla 4). Hay consenso en no hacer cribado poblacional, pero no hay unanimidad en las indicaciones de a quién hay que determinar la vitamina D, que van desde muy restrictivos a prácticamente todo el mundo. La mayoría de las recomendaciones son criterios de expertos con poca evidencia cientí-fica.
Concentraciones séricas de 25?(OH)?D
| Efectos óseos | ||
|---|---|---|
| <12 ng/ml (<30 nmol/l) | Deficiencia | Defecto en la mineralizacióna |
| 12-20 ng/ml (<50 nmol/l) | Insuficiencia | Aumento del remodelado y/u hormona paratiroidea en algunos sujetosb |
| >20 ng/ml (>50 nmol/l) | Suficiencia | Efecto neutro. Objetivo |
| >30 ng/ml (>75 nmol/l) | Óptimo | Efecto neutroObjetivo en pacientes ancianos con caídas frecuentes |
aDeficiencia severa: raquitismo/osteomalacia.
bHipovitaminosis D: fragilidad ósea.
La tabla 2 enumera los principales grupos de riesgo a los que se recomienda determinar las concentraciones séricas de 25?(OH)?D6.
Requerimientos y suplementosLas necesidades de vitamina D varían de persona a persona. La necesidad diaria media se estima en 400 UI/día45,51. La ingesta recomendada es de 600 UI/día para adultos hasta los 70 años y 800 UI/día para los mayores de 70 años. Se recomienda no superar el límite superior tolerable, que sería para adultos y ancianos las 4.000 UI/día (IOM), aunque hay estudios que han ensayado dosis más altas, de hasta 10.000 o más unidades al día sin evidenciar riesgo.
Obtener suficiente vitamina D por fuentes naturales puede ser difícil. Los alimentos enriquecidos16 y la exposición solar suficiente son esenciales para conseguir un estatus de vitamina D correcto. Por cada 2,5 μg (100 UI)/día, el 25?(OH)?D aumenta entre 2,5 y 5 nmol/l (0,5-1 ng/ml), pero hay mucha variabilidad.
No se recomienda la prescripción de suplementos a la población general, pues tratar a sujetos asintomáticos sin pertenecer a grupos de riesgo no ha demostrado que mejore la salud46.
Algunas organizaciones9,47,52 recomiendan suplementar rutinariamente a grupos de alto riesgo, sin necesidad de determinar previamente ni monitorizar las concentraciones de 25?(OH)?D, como los pacientes con tez oscura (africanos, centroamericanos e individuos del sudoeste asiático), pacientes institucionalizados, con elevado riesgo de caídas y/o fracturas por fragilidad, sujetos con poca o nula exposición solar por motivos culturales, médicos u otros, lactantes de menos de 1 año con lactancia materna exclusiva y todos los niños entre 1 y 4 años. También niños y adultos con obesidad (IMC> 30). La dosis recomendada es de 400 UI (10 μg/día), que evitaría raquitismo y osteomalacia y es poco probable que tenga efectos perjudiciales.
Respecto a los suplementos existen varias formas de vi-tamina D comercializadas: colecalciferol, calcifediol, cal-citriol. Algunos se presentan asociados a calcio. Las for-mulaciones semanales o mensuales podrían tener mejor adherencia y se han demostrado igualmente eficaces.
Los suplementos de vitamina D están contraindicados en pacientes con hipercalcemia, y deben emplearse con precaución en pacientes con hiperfosfatemia.
Existen distintas pautas5,53–55 para tratar a los pacientes con deficiencia (<30 nmol/l):
- •
Dosis de carga: (300.000 UI) se puede prescribir 50.000 UI de colecalciferol semanales durante 6 semanas o 30.000/semana durante 10 semanas. Cuando las concentraciones estén normalizadas se recomiendan dosis de mantenimiento de 400-800 UI/día56 o equivalente.
- •
Otra opción es el calcidiol, 16.000 UI/semana durante 4-6 semanas, seguida de la dosis de mantenimiento una vez normalizada.
- •
En caso de insuficiencia (<50 nmol/l): dosis de carga de 25.000 UI/semana durante 6 semanas o 15.000 UI/semana durante 10 semanas.
Cuando se dan dosis de carga es necesario realizar la determinación de la calcemia al mes, y a los 3 meses la calcemia, la fosfatemia, las fosfatasas alcalinas y la PTH. Se recomienda realizar dicha determinación no antes de 4 semanas de la última dosis administrada.
Una vez alcanzados los niveles óptimos, no se recomienda la determinación rutinaria de 25?(OH)?D.
ToxicidadLa intoxicación por vitamina D es extremadamente rara. Suele ocurrir por errores en la dosificación de suplementos57: dosis excesivas y durante periodos prolongados de tiempo o en pacientes que toman ingestas muy altas de calcio. La sintomatología es muy inespecífica e incluye anorexia, pérdida de peso, poliuria y arritmias cardiacas. La hipercalcemia y la hipercalciuria son los signos de alarma que deben hacernos sospechar intoxicación por vitamina D. También pueden presentar nefrolitiasis, calcificación de tejidos blandos o daño vascular.
ConclusionesEn los últimos años se ha constatado un creciente interés acerca de la posible deficiencia de vitamina D y los efectos clínicos asociados. Ello ha conducido a un aumento exponencial en el número de determinaciones, seguido de tratamientos y retest no siempre apropiados. Hay que adecuar las solicitudes a grupos de especial riesgo, en los que es importante confirmar la deficiencia y corregirla oportunamente.
Referencia no citada40.