- •
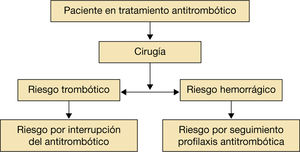
La decisión de suspender o continuar el tratamiento antitrombótico debe ser individualizada y depende del riesgo trombótico y hemorrágico del propio paciente.
- •
La mayoría de los procedimientos intervencionistas requieren una interrupción del tratamiento anticoagulante. Se recomienda no interrumpir en procedimientos de bajo riesgo.
- •
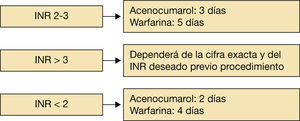
Si el índice internacional normalizado (INR) está entre 2 y 3 (rango terapéutico), se recomienda suspender el acenocumarol y la warfarina (3 y 5 días, respectivamente). Si el INR es inferior a 2, suspender 2 y 4 días antes, respectivamente. Si el INR es superior a 3, dependerá de la cifra exacta y del INR deseado previo al procedimiento.
- •
Para la suspensión de los anticoagulantes orales directos se ha de tener en cuenta el aclaramiento de creatinina y el riesgo hemorrágico de la intervención.
- •
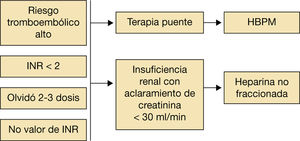
Se recomienda el uso de terapia puente con heparina de bajo peso molecular en pacientes con riesgo tromboembólico alto.
- •
Normalmente se recomienda reintroducir la anticoagulación a las 24 horas si el riesgo hemorrágico es bajo. Si el riesgo hemorrágico es alto, reintroducir a las 48-72 horas.
- •
En general se ha de mantener el ácido acetilsalicílico (AAS), salvo en intervenciones con muy alto riesgo hemorrágico, donde se puede suspender 3 días antes. Si el paciente toma otro antiagregante, se recomienda cambiar a AAS 100mg. Si toma AAS 300mg, bajar a AAS 100mg.
- •
En pacientes con doble antiagregación, riesgo trombótico alto y hemorrágico bajo no suspender el AAS. En riesgo hemorrágico moderado-alto en los que han transcurrido más de 30 días tras el evento: individualizar.
- •
La reintroducción de los antiagregantes como norma general se realiza a las 24 horas de la intervención.
- •
No está recomendado el uso de heparina como terapia puente en pacientes con antiagregantes.
El número de pacientes que se encuentran en tratamiento antitrombótico ha aumentado significativamente. En la inmensa mayoría de ocasiones se trata de un tratamiento crónico que el paciente llevará a lo largo de toda su vida, por lo que no será extraño que en algún momento tenga que realizar un procedimiento quirúrgico o intervencionista. En estos casos, el propio paciente o bien el médico que va a realizar el procedimiento solicita que los médicos de familia orientemos la actitud que debe seguirse.
En el mejor de los casos, cada servicio hospitalario y/o cada hospital realiza su propio protocolo de actuación. En otras ocasiones no existe ningún tipo y depende del criterio de cada profesional.
Habitualmente tendemos a dar mayor importancia a los riesgos de suspender el tratamiento anticoagulante (riesgo de fenómenos tromboembólicos) e infravaloramos los riesgos que conlleva la suspensión del tratamiento antiagregante, cuando realmente la interrupción prematura del antiagregante se asocia con mayor riesgo de eventos cardiovasculares (sobre todo la trombosis del stent en pacientes portadores del mismo)1,2.
La decisión de mantener o retirar dicha terapia está determinada por el riesgo trombótico, así como por el riesgo hemorrágico. Del equilibrio entre estos dos factores dependerá la actitud a tomar ante la anticoagulación y la antiagregación; por tanto, se trata de una decisión individualizada en cada paciente.
Recientemente se ha realizado un documento de consenso elaborado por 23 sociedades científicas que propone una serie de recomendaciones acerca del manejo de los fármacos antitrombóticos en el período perioperatorio.
Las recomendaciones del presente artículo toman como eje central dicho documento, donde se abordan de forma clara las situaciones más frecuentes que nos podemos encontrar en la práctica clínica diaria1.
Terapéutica actual disponibleLos antiagregantes plaquetarios y los anticoagulantes desempeñan un papel fundamental en el tratamiento para la prevención de fenómenos tromboembólicos, mecanismo implicado en diversas entidades: síndrome coronario agudo, enfermedad tromboembólica venosa, tras procedimiento intervencionista como la colocación de válvulas cardíacas mecánicas, enfermedad cerebrovascular y enfermedad arterial coronaria1–5.
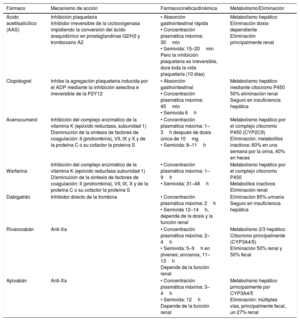
En función de su mecanismo de acción, los antitrombóticos se clasifican en antiagregantes y anticoagulantes (tabla 1).
Resumen de algunas características principales de los principales fármacos antitrombóticos orales de uso más frecuente
| Fármaco | Mecanismo de acción | Farmacocinética/dinámica | Metabolismo/Eliminación |
|---|---|---|---|
| Ácido acetilsalicílico (AAS) | Inhibición plaquetaria Inhibidor irreversible de la ciclooxigenasa impidiendo la conversión del ácido araquidónico en prostaglandinas G2/H2 y tromboxano A2 | • Absorción gastrointestinal rápida • Concentración plasmática máxima: 30min • Semivida: 15–20min Pero la inhibición plaquetaria es irreversible, dura toda la vida plaquetaria (10 días) | Metabolismo hepático Eliminación dosis-dependiente Eliminación principalmente renal |
| Clopidogrel | Inhibe la agregación plaquetaria inducida por el ADP mediante la inhibición selectiva e irreversible de la P2Y12 | • Absorción gastrointestinal • Concentración plasmática máxima: 45min • Semivida 6h | Metabolismo hepático mediante citocromo P450 50% eliminación renal Seguro en insuficiencia hepática |
| Acenocumarol | Inhibición del complejo enzimático de la vitamina K (epóxido reductasa, subunidad 1) Disminución de la síntesis de factores de coagulación: II (protrombina), VII, IX y X y de la proteína C o su cofactor la proteína S | • Concentración plasmática máxima: 1–3h después de dosis única de 10mg • Semivida: 8–11h | Metabolismo hepático por el complejo citocromo P450 (CYP2C9) Eliminación: metabolitos inactivos: 60% en una semana por la orina, 40% en heces |
Warfarina | Inhibición del complejo enzimático de la vitamina K (epóxido reductasa subunidad 1) Disminución de la síntesis de factores de coagulación: II (protrombina), VII, IX, X y de la proteína C o su cofactor la proteína S | • Concentración plasmática máxima: 1–9h • Semivida: 31–48h | Metabolismo hepático por el complejo citocromo P450 Metabolitos inactivos Eliminación renal |
| Dabigatrán | Inhibidor directo de la trombina | • Concentración plasmática máxima: 2h • Semivida 12–14h, depende de la dosis y la función renal | Eliminación 85% urinaria Seguro en insuficiencia hepática |
| Rivaroxabán | Anti-Xa | • Concentración plasmática máxima: 2–4h • Semivida: 5–9h en jóvenes; ancianos, 11–13h Depende de la función renal | Metabolismo 2/3 hepático Citocromo principalmente (CYP3A4/5) Eliminación 50% renal y 50% fecal |
| Apixabán | Anti-Xa | • Concentración plasmática máxima: 3–4h • Semivida: 12h Depende de la función renal | Metabolismo hepático principalmente por CYP3A4/5 Eliminación: múltiples vías, principalmente fecal, un 27% renal |
El riesgo tromboembólico se clasifica en bajo, moderado y alto en función de la probabilidad de que se produzca un evento tromboembólico anual (arterial o venoso). En la tabla 2 se resume la estratificación del riesgo tromboembólico en pacientes con anticoagulantes según las tres causas más frecuentes de prescripción de los mismos1–11.
Estratificación del riesgo tromboembólico de los pacientes en tratamiento anticoagulante
| Riesgo | Motivo de la anticoagulación | ||
|---|---|---|---|
| Fibrilación auricular | Válvulas cardíacas mecánicas | Enfermedad tromboembólica venosa | |
| Bajo | Sin ictus/AIT previo CHA2-DS2-VASc 1-4 | Posición aórtica sin factores de riesgo | TEV > 12 meses |
| Moderado | Ictus/AIT > 3 meses CHA2-DS2-VASc 5-6 | Posición aórtica más 1 factor de riesgo (FA, ictus/AIT previo > 6 meses, DM, IC, edad > 75 años | TEV 3–12 meses previos Trombofilia no grave TEV recurrente TEV + cáncer activo |
| Alto | Ictus/AIT >3 meses Valvulopatía reumática mitral CHA2-D52-VASc 7-9 | Posición mitral Posición tricuspídea (incluso biológicas) Posición aórtica (monodisco) Ictus/AIT < 6 meses | TEV reciente (<3 meses) Trombofilia grave |
Así mismo, tenemos que valorar el riesgo trombótico del tipo de intervención quirúrgica. La tabla 3 muestra la valoración del riesgo en función del tipo de cirugía.
Riesgo tromboembólico en función del tipo de intervención
| Riesgo | Tipo de cirugía |
|---|---|
| Alto | Artroplastia de cadera Artoplastia de rodilla Fractura de cadera Cirugía abdominal mayor Cirugía por neoplasia |
| Moderado | Artroscopia Apendicectomía complicada Duración de la cirugía > 60min Ligamentoplastia de rodilla Esterilización tubárica Herniorrafia bilateral |
| Bajo | Fractura de tibia Inmovilización ambulatoria con yeso Duración de la cirugía < 60min Apendicectomía simple Cirugía de tejidos blandos Herniorrafia unilateral Colecistectomía Legrado obstétrico Hallux valgus |
Adaptado de Llau JV et al12.
De igual forma que el riesgo tromboembólico, el riesgo hemorrágico se clasifica en función de las características del procedimiento que se vaya a realizar (tabla 4). Se estratifica en tres grupos: bajo (intervenciones en las cuales la hemostasia se puede conseguir adecuadamente), moderado (procedimientos en los que la hemostasia quirúrgica puede ser difícil y la hemorragia aumenta la necesidad de transfusión o reintervención) y alto (hemorragia perioperatoria que puede comprometer la vida del paciente o el resultado de la cirugía)1,2,10.
Estratificación general del riesgo hemorrágico según tipo intervención
| Riesgo | Tipo de cirugía |
|---|---|
| Alto | Tipo de cirugía en la que la hemorragia puede comprometer la vida del paciente o el resultado de la cirugía: • Neurocirugía intracraneal • Canal medular • Cámara posterior del ojo |
| Moderado | Intervenciones en las que la hemorragia aumenta la necesidad de transfusión o reintervención. La hemostasia puede ser difícil: • Cirugía mayor visceral • Cardiovascular • Ortopédica mayor • Amigdalectomía • Cirugía reconstructiva • Cirugía urológica endoscópica (resección transuretral de próstata) |
| Bajo | Cirugías que permiten una hemostasia adecuada. Un posible sangrado no supone un riesgo vital para el paciente ni compromete el resultado de la cirugía: • Cirugía menor y periférica • Cirugía plástica • Ortopédica menor • Otorrinolaringología endoscópica • Cámara anterior del ojo • Procedimientos odontológicos |
Adaptado de Sierra P et al4.
Si bien el riesgo hemorrágico depende fundamentalmente del tipo de procedimiento (tablas 4 y 5), existen otros factores inherentes al paciente y al medio que pueden elevar la probabilidad de hemorragia. Estos factores han sido establecidos en escalas de riesgo hemorrágico de enfermedades prevalentes como la fibrilación auricular o el síndrome coronario agudo.
Estratificación del riesgo hemorrágico en procedimientos urológicos
| Bajo riesgo | Uretropexia TOT Cateterismo ureteral Cistoscopia Hidrocelectomía Orquidopexia Torsión testicular Vasectomía Circuncisión Cirugía escrotal Inyección de toxina botulínica intravesical | Ureterorrenoscopia Uretrotomía Varicocelectomía Orquidectomía Biopsia testicular Epididimectomía Vasovasostomía Cirugía de cuerpo cavernoso Neuromodulación |
| Riesgo intermedio | Litotricia extracorpórea Nefrostomía Cirugía del uréter Cistoplastia Uretroplastia | Pieloplastia Endopielotomía Diverticulotomía vesical Biopsia de próstata Corrección de cistocele con malla |
| Alto riesgo | Nefrectomía parcial Nefrectomía simple Biopsia renal Prostatectomía radical RTU de próstata RTU vesical | Nefrectomía radical Nefrolitotomía percutánea Cistectomía Adenomectomía de próstata |
RTU: resección transuretral; TOT: cinta transobturadora.
Adaptado de Furundarena Salsamendi JR et al2.
A estos factores se añaden los siguientes: antecedentes de hemorragia espontánea en los 3 meses previos a la intervención, trombocitopenia o trombopatía, así como variabilidad en el índice internacional normalizado (INR)1,3,10.
En el caso de procedimientos no quirúrgicos (cardiología intervencionista, broncoscopias, endoscopias, odontología y radiología vascular) no hay estratificación clara del riesgo; en general se asume como riesgo bajo cuando la probabilidad de hemorragia es menor del 1% e intermedio-alto si el porcentaje es mayor1,2,10.
En relación con procedimientos urológicos, la valoración del riesgo hemorrágico se clasifica igualmente en bajo, medio o alto como se muestra en la tabla 6.2
Recomendaciones sobre la retirada de los anticoagulantes orales previo a procedimiento/cirugía, en función del riesgo hemorrágico
| Fármaco | Riesgo hemorrágico | Días de suspensión hasta la cirugía | |||||||
|---|---|---|---|---|---|---|---|---|---|
| −7 | −6 | −5 | −4 | −3 | −2 | −1 | 0 | ||
| Acenocumarol Warfarina | INR < 2 | Warfarina | Acenocumarol | Control INR | Cirugía | ||||
| INR 2–3 | Warfarina | Acenocumarol | Control INR | Cirugía | |||||
| INR > 3 | Warfarina | Acenocumarol | Control INR | Cirugía | |||||
| Dabigatrán | Medio-bajo | ClCr < 50 | ClCr < 50-79 | ClCr ≥ 80 | Cirugía | ||||
| Alto | ClCr < 50 | ClCr < 50-79 | ClCr ≥ 80 | Cirugía | |||||
| Rivaroxabán Apixabán Edoxabán | Medio-bajo | ClCr 15-30 | ClCr ≥ 30 | Cirugía | |||||
| Alto | ClCr 15-30 | ClCr ≥ 30 | Cirugía | ||||||
ClCr: aclaramiento de creatinina; INR: índice internacional normalizado.
Adaptado de Vivas D et al1.
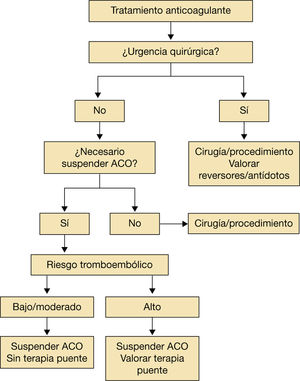
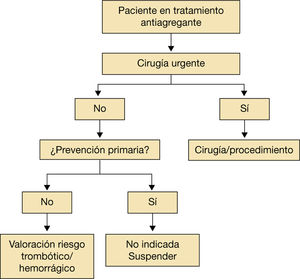
Se recomienda una serie de pasos sencillos que valoren el riesgo hemorrágico frente al tromboembólico en el momento de decidir la conducta que ha de seguirse en el periodo perioperatorio/periprocedimiento (fig. 1). La mayoría de los procedimientos intervencionistas requieren la interrupción del tratamiento anticoagulante. No obstante, se describen algunos en los que mantener el tratamiento anticoagulante conlleva un riesgo muy bajo de hemorragia asumible por el médico. En pacientes a los que se les implantó un marcapasos o un desfibrilador, pacientes sometidos a ablación por catéter de venas pulmonares, se ha demostrado que mantener el tratamiento con antivitamina K (AVK) con INR<3 se asocia con menor riesgo de hemorragia que el uso de terapia puente con heparina de bajo peso molecular (Estudio BRUISE CONTROL5 y. COMPARE6). A pesar de estos resultados se necesitan más estudios para realizar recomendaciones definitivas1–7,9.
Valoración individualizada del riesgo trombótico frente al hemorrágico.
Adaptado de Vivas D et al1.
En general, el grupo de trabajo que participa en el proceso asistencial del paciente durante el periodo perioperatorio o periprocedimiento recomienda no interrumpir la anticoagulación en procedimiento de bajo riesgo en el que, si existe una posible hemorragia, puede ser asumible por el operador. Las figuras 1 y 2 resumen estos comentarios1–4.
Recomendaciones para la retirada de los anticoagulantes.
ACO: anticoagulantes orales.
Adaptado de Vivas D et al1.
La decisión de en qué momento suspender la anticoagulación depende directamente de la vía de eliminación de los distintos fármacos utilizados. Así, los AVK presentan un metabolismo predominantemente hepático y mínimamente renal, por lo que, salvo en el paciente con hepatopatía, en general se recomienda suspender el acenocumarol 3 días antes del procedimiento y la warfarina 5 días antes si el INR está en rango terapéutico (INR 2-3).
Si el INR es supraterapéutico o el riesgo hemorrágico del procedimiento es alto, dependerá de la cifra exacta y del INR deseado previo procedimiento.
Si el INR se encuentra en rango subterapéutico, el acenocumarol se puede suspender 2 días antes y la warfarina 4 días antes (fig. 3)1–10.
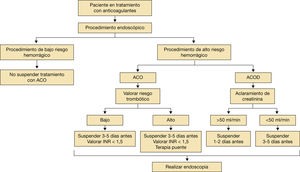
En cuanto a los anticoagulantes directos (ACOD), ya que su farmacocinética es predecible y depende de la función renal, la decisión de cuándo suspender depende del aclaramiento de creatinina y del riesgo hemorrágico de la intervención. La tabla 6 resume las recomendaciones sobre la retirada de los anticoagulantes orales (ACO) previo procedimiento teniendo en cuenta el riesgo hemorrágico1–10.
Valoración de la terapia puenteSe ha visto que el riesgo tromboembólico asociado con la interrupción de los ACO sin terapia puente con heparina es bajo. Algunos estudios demuestran que su uso asocia mayor riesgo de hemorragia sin beneficios en el riesgo tromboembólico.
De acuerdo con la evidencia disponible, se recomienda el uso de terapia puente en paciente con riesgo tromboembólico alto. En cuanto a los AVK es suficiente con heparina de bajo peso molecular (HBPM) cuando el INR sea menor de 2, no se disponga de valor del INR o tras omitir 2-3 dosis del fármaco. En caso de insuficiencia renal con aclaramiento de creatinina inferior a 30ml/min se deberá emplear heparina no fraccionada (fig. 4).
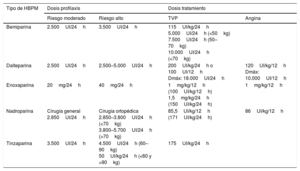
En la tabla 7 se muestran las dosis recomendadas de las distintas HBPM comercializadas en España.
Resumen de dosis de heparina de bajo peso molecular comercializadas en España
| Tipo de HBPM | Dosis profilaxis | Dosis tratamiento | ||
|---|---|---|---|---|
| Riesgo moderado | Riesgo alto | TVP | Angina | |
| Bemiparina | 2.500UI/24h | 3.500UI/24h | 115UI/kg/24h 5.000UI/24h (<50kg) 7.500UI/24h (50–70kg) 10.000UI/24h (<70kg) | |
| Dalteparina | 2.500UI/24h | 2.500–5.000UI/24h | 200UI/kg/24h o 100UI/12h Dmáx: 18.000UI/24h | 120UI/kg/12h Dmáx: 10.000UI/12h |
| Enoxaparina | 20mg/24h | 40mg/24h | 1mg/kg/12h (100UI/kg/12h) 1,5mg/kg/24h (150UI/kg/24h) | 1mg/kg/12h |
| Nadroparina | Cirugía general 2.850UI/24h | Cirugía ortopédica 2.850–3.800UI/24h (<70kg) 3.800–5.700UI/24h (>70kg) | 85,5UI/kg/12h (171UI/kg/24h) | 86UI/kg/12h |
| Tinzaparina | 3.500UI/24h | 4.500UI/24h (60–90kg) 50UI/kg/24h (<60 y >90kg) | 175UI/kg/24h | |
HBPM: heparinas de bajo peso molecular; TVP: trombosis venosa profunda.
Fuente: elaboración propia.
La última dosis de HBPM se debe administrar de 12-24 horas antes de la intervención: 12 horas si se tratase de dosis profiláctica y 24 horas la dosis terapéutica. La última dosis de heparina no fraccionada debe ser entre 4 y 6 horas antes del procedimiento1–13.
Reintroducción de la anticoagulaciónEl factor principal para reiniciar la terapia anticoagulante es haber conseguido una adecuada hemostasia durante la intervención y la ausencia de hemorragia activa posprocedimiento. En la figura 5 se ilustran las recomendaciones para la reintroducción de la anticoagulación.
En general, se recomienda reintroducir la anticoagulación a las 24 horas del procedimiento. En paciente con alto riesgo tromboembólico, debido a que el efecto de los AVK se inicia entre 24 y 72 horas, es necesaria la terapia puente con heparina. En los pacientes con ACOD no es necesario este tipo de terapia.
Si el paciente presenta un alto riesgo hemorrágico postoperatorio, se pospondrá el inicio de la anticoagulación oral entre 48 y 72 horas.
Si el paciente no puede utilizar la vía oral para el tratamiento, se han de valorar los antitrombóticos parenterales, de preferencia las HBPM a dosis balanceada para cubrir riesgo trombótico y minimizar el hemorrágico1–10.
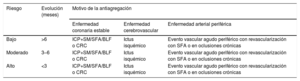
AntiagregantesEn el caso de tratamiento con antiagregantes, para definir el riesgo trombótico se han de considerar aspectos como: tiempo transcurrido desde que se originó el evento hasta la realización de la intervención, tipo de presentación del evento (agudo frente a estable), las características clínicas del paciente y el tratamiento realizado. En función de la combinación de estos factores, el riesgo se clasifica en alto, moderado y bajo, como se resume en la tabla 8.1–13
Estratificación del riesgo trombótico de los pacientes en tratamiento antiagregante
| Riesgo | Evolución (meses) | Motivo de la antiagregación | ||
|---|---|---|---|---|
| Enfermedad coronaria estable | Enfermedad cerebrovascular | Enfermedad arterial periférica | ||
| Bajo | >6 | ICP+SM/SFA/BLF o CRC | Ictus isquémico | Evento vascular agudo periférico con revascularización con SFA o en oclusiones crónicas |
| Moderado | 3–6 | ICP+SM/SFA/BLF o CRC | Ictus isquémico | Evento vascular agudo periférico con revascularización con SFA o en oclusiones crónicas |
| Alto | <3 | ICP+SM/SFA/BLF o CRC | Ictus isquémico | Evento vascular agudo periférico con revascularización con SFA o en oclusiones crónicas |
BLF: balón liberador de fármacos; CRC: cirugía de revascularización coronaria; ICP: intervención coronaria percutánea; SFA: stent farmacoactivo; SM: stent metálico.
Adaptado de Vivas D et al1.
Como se muestra en la tabla 9, el tiempo transcurrido entre el episodio isquémico y la intervención es el principal determinante de que se produzcan eventos relacionados con la suspensión de la antiagregación plaquetaria. Existe un mayor riesgo de eventos trombóticos en cirugías urgentes y cuando la cirugía programada se realiza antes de los primeros 6 meses tras implante de stent coronario1,9,12.
Estratificación del riesgo trombótico de los pacientes en tratamiento antiagregante
| Riesgo | Evolución (meses) | Motivo de la antiagregación |
|---|---|---|
| Síndrome coronario agudo | ||
| Bajo | >6 | Tratamiento médico |
| >12 | ICP+SM/SFA/BLF, CRC, o si la IPC conlleva más de uno de los siguientes factores de riesgo: ictus/AIT previo, DM, IRC, FEVI < 30%, procedimiento complejo (stents largos, múltiples, bifurcaciones, TCI, vasos únicos, solapamientos, vasos < 2,5mm o injertos de vena safena | |
| <12 | ICP+SFA de primera generación (rapamicina, paclitaxel) y stents con armazón vascular absorbibles | |
| Moderado | 3–6 | Tratamiento médico |
| 6–12 | ICP+SM/SFA/BLF, CRC, o si la IPC conlleva más de uno de los siguientes factores de riesgo: ictus/AIT previo, DM, IRC, FEVI < 30%, procedimiento complejo (stent largos, múltiples, bifurcaciones, TCI, vasos únicos, solapamientos, vasos < 2,5mm o injertos de vena safena | |
| >12 | ICP+SFA de primera generación (rapamicina, paclitaxel) y stents con armazón vascular absorbibles | |
| Alto | <3 | Tratamiento médico |
| <6 | ICP+SM/SFA/BLF, CRC, o si la IPC conlleva más de uno de los siguientes factores de riesgo: ictus/AIT previo, DM, IRC, FEVI < 30%, procedimiento complejo (stents largos, múltiples, bifurcaciones, TCI, vasos únicos, solapamientos, vasos < 2,5mm o injertos de vena safena |
AIT: accidente isquémico transitorio; BLF: balón liberador de fármacos; CRC: cirugía de revascularización coronaria. ICP: intervención coronaria percutánea; SFA: stent farmacoactivo SM: stent metálico.
Adaptado de Vivas D et al1.
Uno de los aspectos más relevantes en la valoración del riesgo trombótico es el tipo de stent implantado. En el caso de pacientes tratados con cirugías de revascularización coronaria o mediante tratamiento médico no invasivo, el riesgo de complicaciones es mucho menor. Los pacientes con síndrome coronario agudo tienen más riesgo que aquellos con enfermedad coronaria estable.
Es de interés valorar la comorbilidad del paciente; factores como diabetes mellitus, enfermedad renal crónica, disfunción ventricular grave o antecedentes de ictus y/o accidente isquémico transitorio se asocian con un aumento del riesgo de trombosis.
La necesidad de una intervención quirúrgica en pacientes con ictus reciente presenta un riesgo aumentado, sobre todo en los primeros 30 días en caso de suspender la antiagregación. En la enfermedad arterial periférica se describen casos de trombosis en el primer mes, siendo de más riesgo los pacientes tratados con SFA o stent para oclusiones crónicas1,5,10.
Recomendaciones sobre la duración de la doble antiagregación plaquetariaLa duración de la doble antiagregación varía en función de la entidad que padece el paciente1,5,10,14:
- •
Enfermedad arterial periférica: 1 mes de doble antiagregación plaquetaria (DAP) tras colocación de stent.
- •
Enfermedad carotídea: 1 mes de DAP tras colocación de stent.
- •
Enfermedad coronaria estable: sin alto riesgo hemorrágico: entre 6 y 12 meses. Con alto riesgo hemorrágico: entre 1 y 4 meses.
- •
Síndrome coronario agudo: sin alto riesgo hemorrágico: 12 meses. Con alto riesgo hemorrágico: 6 meses.
Lo primero que debe quedar claro es que no está indicada la antiagregación en prevención primaria (fig. 6); por ello, en cualquier paciente que vaya a ser intervenido, está indicado retirar el antiagregante y ya no volver a introducirlo1–10.
Valoración del paciente en tratamiento con antiagregantes que va a ser sometido a cirugía urgente.
Adaptado de Vivas D et al1.
Además de valorar el riesgo trombótico y hemorrágico, tenemos que considerar cuál ha sido la indicación del tratamiento antiagregante y el tipo que usa el paciente.
Como norma general, el AAS a dosis de 100mg se debe de mantener salvo en intervenciones con muy alto riesgo hemorrágico (procedimientos neuroquirúrgicos) donde podemos suspenderlo 3 días antes del procedimiento. Si la dosis de AAS es superior a 100mg, cambiar a 100mg (si toma 300mg, no se considera contraindicación para no realizar la intervención).
Si el paciente toma otro antiagregante (monoterapia con inhibidor del P2Y12) se debe suspender el fármaco de 3 a 7 días antes y plantearse cambiar a AAS 100mg si es posible1–10.
Pacientes con DAP:
- •
Si el riesgo trombótico es alto y el riesgo hemorrágico bajo: no suspender.
- •
Si el riesgo hemorrágico es moderado-grave y han pasado más de 30 días tras el evento por el que se pautó: individualizar.
- •
En general se intenta evitar la suspensión de DAP durante los primeros 30 días tras el evento por el que se indicó.
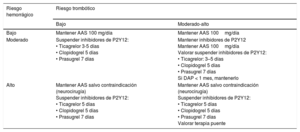
En la tabla 10 se resumen estas recomendaciones en función del riesgo trombótico frente al hemorrágico.
Recomendaciones sobre la retirada del tratamiento antiagregante en función del riesgo trombótico frente al hemorrágico
| Riesgo hemorrágico | Riesgo trombótico | |
|---|---|---|
| Bajo | Moderado-alto | |
| Bajo | Mantener AAS 100 mg/día | Mantener AAS 100mg/día |
| Moderado | Suspender inhibidores de P2Y12: • Ticagrelor 3-5 días • Clopidogrel 5 días • Prasugrel 7 días | Mantener inhibidores de P2Y12 Mantener AAS 100mg/día Valorar suspender inhibidores de P2Y12: • Ticagrelor: 3–5 días • Clopidogrel 5 días • Prasugrel 7 días Si DAP < 1 mes, mantenerlo |
| Alto | Mantener AAS salvo contraindicación (neurocirugía) Suspender inhibidores de P2Y12: • Ticagrelor 5 días • Clopidogrel 5 días • Prasugrel 7 días | Mantener AAS salvo contraindicación (neurocirugía) Suspender inhibidores de P2Y12: • Ticagrelor 5 días • Clopidogrel 5 días • Prasugrel 7 días Valorar terapia puente |
AAS: ácido acetilsalicílico. DAP: doble antiagregación plaquetaria.
Fuente: elaboración propia.
El punto clave fundamental a la hora de reintroducir la antiagregación es haber conseguido una adecuada hemostasia durante la intervención y la ausencia de sangrado tras el procedimiento. Como norma general se recomienda reintroducir a las 24 horas de la intervención.
Si el paciente tiene alto riesgo hemorrágico postoperatorio, se inicia entre las 48 y 72 horas1–13.
¿Es necesaria la terapia puente al suspender la antiagregación?Nunca usar heparina como terapia puente en pacientes que utilizan antiagregantes. Si es necesario, se emplean antiagregantes plaquetarios intravenosos (excede el ámbito de la atención primaria).
Como regla general, solo en raras excepciones, y sobre todo en el primer mes tras el evento que indicó la antiagregación, será necesario el uso de la terapia puente1,2,7–11,15.
Manejo de antitrombóticos en procedimientos endoscópicosAl igual que hemos comentado en los apartados anteriores, es fundamental la valoración conjunta del riesgo hemorrágico y trombótico. No hay estratificación clara del riesgo hemorrágico; en general se asume un riesgo bajo cuando la probabilidad de hemorragia es menor del 1% e intermedio-alto si es mayor del 1%.
En cuanto al manejo de los antitrombóticos en procedimientos endoscópicos no hay evidencias tan fuertes como en los demás procedimientos.
En la tabla 11 se muestra la clasificación del riesgo hemorrágico en función del tipo de procedimiento.
Valoración del riesgo hemorrágico en los pacientes sometidos a procedimientos endoscópicos
| Procedimiento endoscópico | |
|---|---|
| Bajo riesgo <1% | Endoscopia diagnóstica con o sin biopsia Colangiopancreatografía retrógrada endoscópica (CPRE) Inserción de stents biliares sin esfinterotomía Ecoendoscopia y enteroscopia de pulsión |
| Alto riesgo 1–6% | Polipectomía endoscópica Coagulopatía y ablación con láser Dilatación de estenosis benignas y malignas Esfinterotomía Ecoendoscopia con punción de lesión quística Mucosectomía y disección submucosa Gastrostomía endoscópica percutánea |
Adaptado de Alberca F et al14.
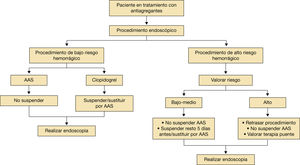
En procedimientos de bajo riesgo hemorrágico se recomienda continuar su uso.
En procedimientos de alto riesgo hemorrágico en general se recomienda suspender:
- •
Si el riesgo trombótico es bajo: suspender 3-5 días (hasta conseguir un INR < 1,5.
- •
Si el riesgo trombótico es alto, además de suspender se ha de emplear la terapia puente (fig. 7).
En el caso de ACOD, valorar el aclaramiento de creatinina:
- •
Si>50ml/min, suspender 1–2 días antes.
- •
Si<50ml/min, suspender 3–5 días antes.
La reintroducción de los ACO por norma general se realiza a las 24 horas del procedimiento.
Si existe alto riesgo de sangrado, a las 48 horas2,16,17.
Manejo de antiagregantesEn los pacientes que van a ser sometidos a procedimientos endoscópicos (fig. 8) se recomienda continuar la administración de AAS en todos excepto en aquellos procedimientos endoscópicos de muy alto riesgo de sangrando según especifica la tabla 11. En este caso se ha de individualizar el riesgo-beneficio2,16,17.
En procedimientos endoscópicos con alto riesgo de sangrado debemos valorar el riesgo trombótico:
- •
Si el riesgo trombótico es bajo-medio:
- –
Si el paciente toma AAS, no suspenderlo.
- –
El resto de los antiagregantes se suspenden 5 días antes (podemos sustituirlos por AAS).
- –
- •
Si el riesgo trombótico es alto:
- –
Se recomienda retrasar el procedimiento (si es posible).
- –
No suspender el AAS.
- –
Valorar la terapia puente.
- –
- •
En pacientes con riesgo bajo de trombosis, o si la posibilidad de polipectomía es elevada, suspender el ACO 5 días antes de la colonoscopia.
- •
Colonoscopia de cribado: algunos grupos la consideran de alto riesgo de sangrado; dada la alta frecuencia de polipectomía (probabilidad > 50%), se ha de valorar ACO a dosis baja o terapia puente. Si la probabilidad de polipectomía es menor o igual al 1%, no suspender16.
- •
Si el paciente toma AAS, no retirarlo.
- •
Si toma clopidogrel, cambiar por AAS.
- •
Si toma DAP retirar clopidogrel y mantener AAS.
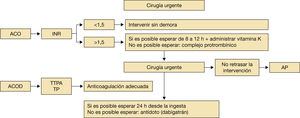
Lo primero es evaluar el estado de anticoagulación del paciente, mediante la determinación del INR para los pacientes con AVK (fig. 9)1,2,6–14,16,17:
- •
Si INR es menor de 1,5, se puede intervenir sin demora.
- •
Si el INR es superior a 1,5: si el paciente puede esperar de 8 a 12 horas, administrar 10mg de vitamina K intravenosa. Si es necesaria cirugía inmediata, administrar complejo protrombínico 25–50 UI/kg según valor del INR actual y objetivo.
En el caso de los ACOD, se valora el tiempo de tromboplastina parcial activada (dabigatrán) y el tiempo de protrombina (rivaroxabán y edoxabán).
Si el estudio de la hemostasia indica actividad anticoagulante o si el cumplimiento terapéutico ha sido adecuado (apixabán, edoxabán) lo ideal sería esperar 24 horas desde la ingesta del anticoagulante, si no es posible administrar antídoto (el idarucizumab en el caso del dabigatrán). Actualmente se están estudiando otros antídotos para el resto de ACOD1,2,15.
AntiagregaciónEn líneas generales no está justificado retrasar la intervención quirúrgica por la toma de antiagregantes1–9,14.
La anestesia neuroaxial se desaconseja en el caso de tratamiento con inhibidores de P2Y12 (no en caso de AAS)1,7,11.